1. Préparation du décocté de Zygophyllum album
La plante est séché à température ambiante, puis la partie aérienne est broyer à l’aide d’un broyeur électrique afin d’obtenir une poudre grossière. 120 g de poudre sont suspendus dans 350 ml d’eau distillée. La suspension est chauffée à petit feu pendant 10 minutes. La décoction est filtrée à l’aide d’une gaze et le filtrat est conservé au frais.
2. Induction du diabète sucré expérimental chez le rat
Afin d’obtenir des rats diabétiques, nous avons préparés extemporanément une solution d’alloxane monohydrate à une concentration de 30 g/l en dissolvant 900 mg d’alloxane dans 30 ml d’eau physiologique. Une dose unique de 200 mg/kg est injectée en intra péritonéal à chaque rat des deux lots : diabétiques non traités et diabétiques traités. Une semaine après l’injection de l’alloxane, la glycémie est mesurée à l’aide d’un glucomètre par section de l’extrémité de la queue de chaque rat. Les rats qui présentés une glycémie supérieur à 120 mg/dl ont étaient considérés diabétiques (glycémie normal chez le rat : 75 – 110 mg/dl) et inclus dans notre étude. Le diabète induit par l’alloxane est un diabète toxique insulinoprive connu sous le nom de « diabète alloxanique »
3. Le protocole de traitement des animaux
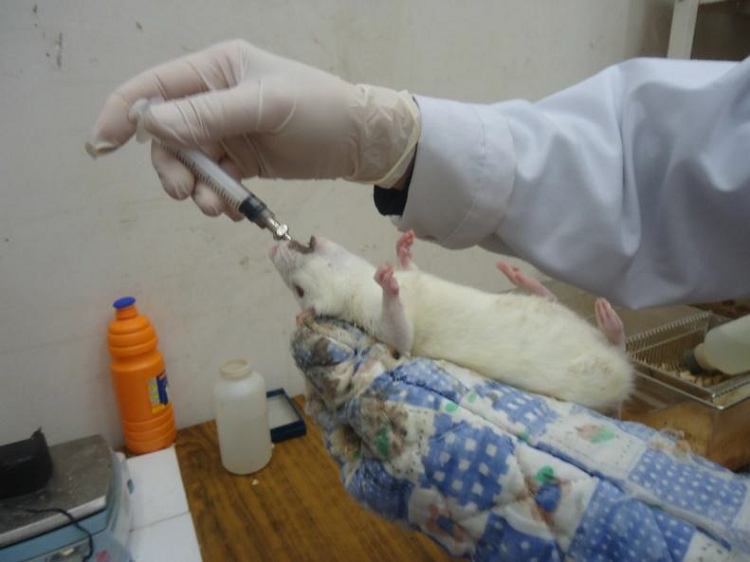
Dans le but de rechercher l’effet antidiabétiques et antioxydant du décocté de Zygophyllum album, les 8 rats du lot diabétiques traités ont reçu, à une posologie de 1 g/kg de rat, le décocté par gavage (per os) à l’aide d’une sonde fixée à une seringue (cf. photo n°2) et ce quotidiennement pendant une durée de 21 jours. Les rats des deux autres lots (témoins et diabétiques non traités) ont reçu dans les mêmes conditions une solution d’eau physiologique.
L’évolution du poids des rats des différents lots est contrôlée durant toute l’expérience : avant et après l’induction du diabète alloxanique ainsi que pendant toute la durée du traitement.
Photo n°2
À la fin du traitement, touts les animaux ont été sacrifiés et les organes (foie et pancréas) prélevés en vue des dosages des paramètres tissulaires.
4. Prélèvement de sang chez le rat
Cette opération est effectuée dans le but du dosage des paramètres sériques de nos rats : triglycérides et transaminases (ASAT et ALAT).
Le prélèvement est réalisé au niveau du sinus rétro-orbital de l’oeil (région cartilagineuse richement vascularisée) à l’aide d’un capillaire à hématocrite préalablement plongé dans une solution d’EDTA (1%). Le sang total est recueilli dans des tubes (5cc) numérotés et centrifugés à 3000 tours/min pendant 10 minutes. Les sérums obtenus sont conservés à (-20°C) en vue du dosage.
Pour les besoins de notre étude, nous avons réalisée 3 prélèvements de sang au niveau di sinus rétro-orbital de l’oeil : le premier au début de l’expérience (T0), le deuxième trois semaines après l’induction du diabète (T1) et le troisième à la fin du traitement (T2).
5. Étude de l’effet du décocté de Z. album sur le glucose sanguin
L’effet antidiabétique du décocté de Z. album est évalué tout au long de notre expérience et ce grâce à un glucomètre et des bandelettes réactives. La glycémie est mesuré durant toute les étapes de notre étude (tout au début de l’étude, pendant la période du diabète ainsi que durant les 3 semaines de traitement) et ce hebdomadairement.
Chaque bandelette est munie d’une zone réactive contenant des réactifs. L’application de sang dans cette zone provoque une réaction chimique qui se traduit par un changement de la couleur de la zone réactive. Le lecteur calcule alors la valeur de la glycémie correspondant à la coloration obtenue. Les résultats obtenus de la glycémie des rats à l’aide du glucomètre sont exprimés en mg/dl.
6. Dosage des paramètres tissulaires
6.1. Étude de l’effet du décoté de Z. album sur le stockage du glycogène au niveau du foie
Pour l’évaluation de l’effet du décocté de Z. album sur le stockage du glycogène au niveau du foie, nous avons quantifié le glycogène hépatique des 3 lots de rats (témoins, diabétiques non traités et diabétiques traités par le décocté) et ce après sacrifice des animaux et prélèvement d’une portion de foie de chaque rat.
Le principe de la méthode consiste à hydrolyser par un acide le glycogène extrait du foie de rats et doser, par une méthode d’oxydoréduction, le glucose ainsi formé. Le protocole en est le suivant :
a. Prélèvement et traitement de l’organe
Après le sacrifice du rat, le foie est rapidement prélevé sur de la glace. Une portion de foie pesé est transférer dans un tube à centrifuger contenant 2 ml de KOH à 30 %. Les tubes sont portés au bain-marie bouillant pendant 30 minutes et sont agités durant cet intervalle. Après cette période, les tubes sont refroidis sous l’eau courante.
b. Précipitation du glycogène
2 gouttes de sulfate de zinc (ZnSO4) à 10 % et 4 ml d’éthanol sont additionnées. Les tubes sont agités et chauffés lentement dans un bain-Marie jusqu’a ébullition, le glycogène hépatique précipite. La suspension obtenu est refroidie et centrifugée à 4500 tours/min pendant 10 minutes et le surnageant est éliminé.
c. Hydrolyse du glycogène précipité
2 ml d’acide sulfurique (H2SO4) à 2.5 N sont ajoutés aux précipités, ensuite les tubes sont chauffés pendant 30 minutes. Cette étape permet l’hydrolyse du glycogène.
d. Neutralisation de l’acidité de l’hydrolysat
Après l’hydrolyse, les tubes sont refroidis et additionnés d’une goutte de phénolphtaléine. De la soude à 2.5 N est ajouté goutte à goutte jusqu’au virage rouge-rose.
Une goutte H2SO4 est ajoutée pour décolorer. Une solution de glucose à pH neutre est ainsi obtenue.
e. Dosage du glucose formé à partir du glycogène
Après avoir extrait, précipiter et hydrolyser le glycogène hépatique, le glucose formé est dosé par la méthode de Folin Wu : cette méthode est basé sur les propriétés réductrices du glucose en milieu alcalin et à chaud. En effet, cette solution de glucose est mise en contact avec un réactif cuivreux se qui va permettre au glucose de réduire l’oxyde cuivrique (Cu2O) et former un produit : l’oxyde cuivreux (CuO2) qui lui-même va réagir avec le réactif phosphomolybdique pour donner une coloration bleu d’autant plus intense qu’il ya d’oxyde cuivreux et de ce fait proportionnelle à la quantité de glucose présente initialement.
L’intensité de la coloration est mesurée par spectrophotométrie.
– Mode opératoire
La solution de glucose ainsi obtenue est transvasée dans une fiole jaugée de 10 ml et complétée avec de l’eau distillée. 0.5 ml, 1 ml et 1.5 ml sont prélevés de cette fiole dans 3 tubes numérotés et complétés à 2 ml avec de l’eau distillé. A chaque tube est ajouté 2 ml de la solution de tartrate cuivrique et agité avant de les placer au bain-marie. Au bout de 8 minutes, les tubes sont refroidis et additionnés de 2 ml de réactif phosphomolybdique, une coloration bleue se forme. Chaque tube est complété à 20 ml avec de l’eau distillé et agités. Après 10 minutes, lecture de différentes densités optiques (échantillons) au spectrophotomètre à une longueur d’onde λ = 530 nm.
Les concentrations de glucose sont déduites d’une gamme étalon préparés à partir d’une solution standard de glucose à 0.5g/l (cf. annexe I). Le calcul des quantités de glycogène est réalisé grâce à l’équation suivante et cela pour les 3 tube : 0.5 ml, 1 ml, 1.5 ml préparés pour chaque échantillon. Les résultats sont exprimés en quantités de glycogène (mg) dans 100 g de foie pour chaque rat.
Les rôles des réactifs utilisés au cours de cette méthode sont décrits dans l’annexe I.
6.2. Étude de l’effet du décoté de Z. album sur les lipides hépatiques
Pour cette étude, les lipides totaux ainsi que les triglycérides sont quantifiés au niveau du foie des rats des 3 lots et cela après sacrifice des animaux.
6.2.1. Quantification des lipides totaux au niveau du foie
Pour quantifier les lipides totaux hépatiques on a eu recours à la Méthode de Folch [Folch et al., 1957]. Celui-ci propose une extraction des lipides du foie par un mélange de solvants polaire/apolaire (chloroforme/méthanol). Le chloroforme permet une dissolution totale des lipides et le méthanol la précipitation des protéines libérées. Ces protéines sont éliminées par lavage avec de l’eau distillé. A la fin, une analyse gravimétrique est réalisée afin de déduire la quantité de lipides hépatique pour chaque rat. La quantité de lipides totaux est exprimée en mg par 100 g de tissu hépatique. Le mode opératoire est le suivant :
a. Prélèvement de l’organe
Juste après la dissection de l’animal, le foie est prélevé, pesé et fragmenté. Un fragment pesé est transférer sur 20 ml de Folch (chloroforme / méthanol, 2/1 : V/V) et conservé à -20°C en vue de son broyage. L’opération est répétée pour chaque rat.
b. Broyage de l’organe
Les organes sont broyés à l’aide d’un mortier. Les broyas obtenus sont filtrés sur du papier filtre dégraissé. Les filtrats sont ainsi recueillis dans des fioles jaugés et ajustés à 20 ml de Folch. Les filtrats sont conservés à -20°C dans des tubes à bouchons hermétiques afin d’éviter les évaporations
c. Lavage et centrifugation
6 ml de nos filtrats ont subis un lavage par de l’eau distillé (0.2 fois le volume du filtrat) afin d’éliminer les protéines passé dans le filtrat. La solution obtenue est centrifugée à 1500 tours/min pendant 10 minutes. Deux phases sont obtenues: l’une supérieure hydrosoluble qui est éliminé, l’autre inferieure, est utilisée pour l’estimation des lipides.
d. Évaporation :
Les phases inferieures sont transvasées dans des tubes préalablement pesés vides et transférés dans une étuve pour une évaporation à 50°C. Après évaporation les tubes sont repesés. La quantité des lipides totaux est déterminée par la différence des deux pesés.
6.2.2. Quantification des triglycérides au niveau du foie
a. Principe de la méthode
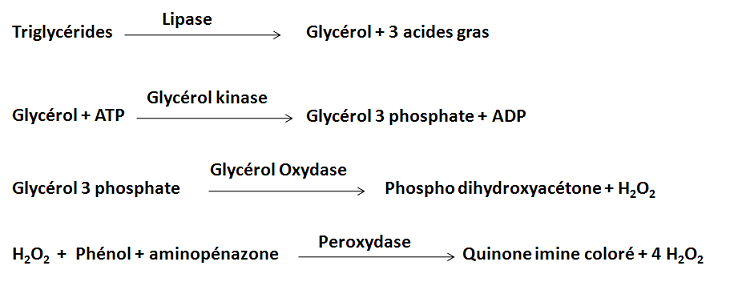
Les triglycérides hépatiques sont dosés à partir des filtrats utlisés pour la quantification des lipides totaux (obtenus après broyage du foie, filtration et ajustement avec du Folch). Le dosage est réalisé grâce à une méthode enzymatique qui dose le glycérol libéré après action de la lipase sur les triglycérides [De la Farge. 2000].
b. Mode opératoire
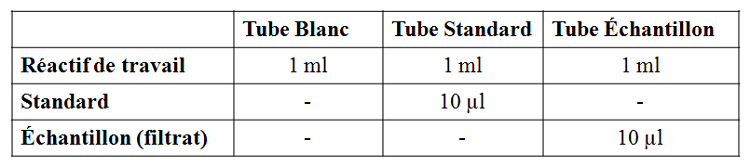
Pour la détermination des triglycérides hépatiques nous avons utilisés un kit qui contient tous les enzymes et constituants cités précédemment dans le principe. Pour cela on a opéré par rapport à un blanc et à un standard dont la concentration en triglycérides était de 51.8 mg/dl.
Après mélange, les échantillons sont incubés pendant 10 minutes. Les densités optiques (blanc, standard et échantillons) sont lues au spectrophotomètre à une longueur d’onde de λ=545 nm. Les concentrations en triglycérides de nos échantillons hépatiques sont calculées à partir de l’équation suivante :
La quantité des triglycérides hépatiques est exprimé en mg/100 g de foie.
6.3. Étude de l’effet du décoté de Z. album sur la peroxydation lipidique au niveau des organes
La peroxydation lipidique au niveau du foie et du pancréas est mesurée par la quantification du malondialdéhyde (MDA), un produit de dégradation des réactions de peroxydation lipidique se formant lors de l’attaque des lipides polyinsaturés par des espèces réactives de l’oxygène.
Le dosage du MDA au niveau de ces organes à été réalisé par une méthode spectrophotométriques : la méthode d’Ohkawa [Ohkawa et al., 1979], cette méthode utilise l’acide thiobarbiturique (TBA). En effet, une molécule de MDA en milieu acide et à chaud est condensée avec deux molécules de TBA pour formé un complexe coloré en rose (cf. figure 14) susceptible d’un dosage spectrophotométrique à une longueur d’onde λ = 532 nm [Michel et al., 2008]. Cette technique présente d’excellentes qualités sur le plan de la sensibilité, sauf qu’elle manque de spécificité à cause des interférences (molécules ne relevant pas du stress oxydant mais réagissant avec le TBA), mais elle reste le test le plus simple et le plus classique qui permet l’évaluation de la peroxydation lipidique [Beauvieux et al., 2002].
Figure 14 : Principe du dosage du MDA [Kebièche., 2009]
– Mode opératoire :
a. Libération du MDA :
– Les organes (foies et pancréas) sont broyés à l’aide d’un mortier sur de la glace. Les broyats ainsi obtenues sont remis dans des eppendorfs et placés dans l’azote liquide.
– Les broyats sont additionné de 1 ml de la solution de lyse (10 ml de Tris 0.1M à pH 6.6+ 0.5 ml de Triton 12.1%) se qui va permettre la libération du MDA.
– Les eppendorfs sont centrifugés à 4400 tour/minutes pendant 30 minutes 4°C.
– Les surnageant sont prélevés et conservés à (- 20°C) en vue du dosage du MDA.
b. Dosage du MDA :
120 μl de surnageant sont additionnés à 450 μl de TBA (0.67 % de TCA) et 300 μl d’acide trichloracétique (TCA à 10 %) se qui va permettre la précipitation des protéines. Cette étape doit être réalisée sur de la glace. Le mélange est porté au bain-marie à 100°C afin de favoriser la réaction du MDA avec le TBA. Après 15 minutes, Les échantillons sont refroidis sur de la glace pendant 5 minutes et centrifugés à 4400 tour/ min à 4°C pour une durée de 30 minutes. Après la centrifugation, il y’a formation d’un surnageant de couleur rose dont l’intensité est lue au spectrophotomètre à une longueur d’onde λ = 532 nm.
Les concentrations de MDA hépatiques et pancréatiques sont déduites à partir d’une gamme étalon (cf. annexe II) établie dans les mêmes conditions que précédemment. Les résultats sont exprimés en μmole de MDA par 100 grammes d’organe.
7. Dosage des paramètres sériques : triglycérides et transaminases
Les triglycérides sériques ainsi que les transaminases (ASAT et ALAT) de chaque rat ont été dosé à différents temps : T0 : début de l’étude, T1 : avant traitement et T3 : fin du traitement. Le dosage a été réalisé à l’aide d’un automate.
8. Analyse statistique
Les résultats sont donnés sous forme de moyennes et E.S.M (erreur standard à moyenne). La comparaison des moyennes à été réalisée en utilisant le test t de Student. La valeur trouvée par le calcul du t peut affirmer que les populations sont différentes avec un risque d’erreur p tel que :
– p > 0,05 = la différence n’est pas significative ns ;
– 0,05 > p > 0,01 = la différence est significative * ;
– 0,01 > p > 0,001 = la différence est hautement significative **;
– p < 0,001 = la différence est très hautement significative ***.



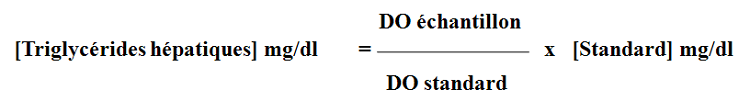
![Principe du dosage du MDA [Kebièche., 2009] Principe du dosage du MDA [Kebièche., 2009]](https://www.institut-numerique.org/wp-content/uploads/2013/10/Principe-du-dosage-du-MDA-Kebièche.-2009.png)