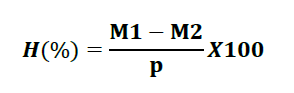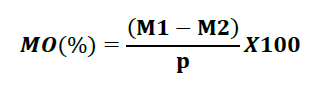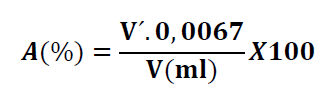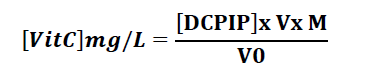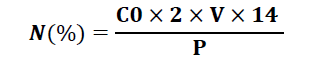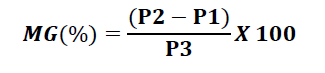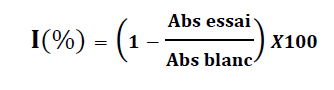I.2.1. Paramètres morphologiques des feuilles
Les paramètres morphologiques des feuilles d’Aloe arborescens ont été étudiés selon la méthode de Zapata et ses collaborateurs (2013).
– Poids des feuilles (g) ;
– Longueur et épaisseur des feuilles (cm) ;
– Largeur à la base et au milieu de la feuille (cm) ;
– Rendement du gel par gramme de feuilles entières (%).
I.2.2. Extraction du gel
Les feuilles d’Aloe arborescens sont lavées avec l’eau distillée et séchées. Les épines sont éliminées à l’aide d’un couteau, ensuite, le latex (un liquide jaune) est extrait en coupant la base des feuilles en le laissant s’écouler verticalement pendant environ 60 minutes. Par après les feuilles sont coupées en deux, afin de collecter le gel à l’aide d’une cuillère dans un flacon fumé et sec, puis le conservé au réfrigérateur. Le gel collecté doit être utilisé dans les 24 heures qui suivent sa préparation ; afin de garder sa composition le plus intacte possible (Femenia et al., 1999 ; Krokida et al., 2011 ; Reyes et al., 2012) .
I.2.2.1. Caractéristiques sensorielles du gel
Les caractéristiques sensorielles du gel ont été étudiées selon la méthode d’Ellis (1999).
– La couleur est déterminée par appréciation visuelle ;
– La consistance est déterminée par le toucher ;
– La saveur est déterminée par le gout.
I.2.3. Anatomie des feuilles et du gel
Les structures internes des feuilles et du gel sont étudiées selon la méthode décrite par Lad (2013).Cette méthode consiste à réaliser une examination microscopique d’une coupe transversale de la feuille et d’une goutte du gel sous la lumière d’un microscope optique équipé d’une caméra digitale.
Les feuilles sont tranchées en coupe très minces à l’aide d’un pisterait, puis mises dans l’eau de javel pendant 4 à 5 min, ensuite rincées avec l’eau distillée. Quelques gouttes d’acide acétique sont ajoutées et laissées pendant 5 min, puis d’autres gouttes de vert d’iode pendant 5 min, suivi d’un rinçage avec l’eau distillée. Ces coupes sont déposées sur des lames et recouvertes de lamelles, après ajout d’une goutte de glycérine, et examinées sous l’objectif (10 x).
Concernant le gel, une goutte de celui-ci est étalée sur une lame et recouverte d’une lamelle puis observée sous l’objectif (100 x) (Ni et al., 2004).
I.2.4.Analyses physico-chimiques du gel et de la purée des feuilles
a. Teneur en humidité (A.O.A.C. no. 934.06. 1990)
Trois creusets vides sont séchés à l’étuve durant 15 min à 103 ± 2 °C, puis tarés après refroidissement dans un dessiccateur. 2 g d’échantillon sont pesés dans chacun des creusets, puis placés dans une étuve réglée à 70 ± 1 °C pendant 6 heures. Les creusets sont retirés de l’étuve et pesés après refroidissement dans un dessiccateur. L’opération est répétée trois fois.
La teneur en eau des échantillons est calculée selon la formule suivante :
Avec :
– H (%) : Humidité ;
– M1 : Masse du creuset contenant la matière fraiche avant étuvage (g) ;
– M2 : Masse du creuset contenant la matière fraiche après étuvage (g) ;
– P : Masse de la prise d’essai (g).
b. Teneur en matière organique et en cendres (A.O.A.C.no. 923.03.1990)
Cette méthode consiste à calciner l’échantillon à 550 °C dans un four à moufle jusqu’à l’obtention d’une cendre blanchâtre de poids constant. 2 g d’échantillon sont pesés dans des creusets et sont ensuite placés dans un four à moufle réglé à 550 °C pendant 5 heures, jusqu’à l’obtention des cendres blanchâtres. Les creusets sont pesés après refroidissement dans un dessiccateur. L’opération est répétée trois fois.
La matière organique est calculée selon la formule suivante :
Avec:
– MO : Matière organique (%);
– M1 : Masse du creuset contenant la prise d’essai(g) ;
– M2 : Masse du creuset et des cendres (g) ;
– P : Poids de la prise d’essai(g).
La teneur en cendres est calculée comme suit : Cendres (%) = 100 – MO
c. Mesure du pH
L’électrode du pH-mètre est plongée dans un bécher contenant 20 ml d’échantillon à 25ºC. L’opération est répétée trois fois (Zapata et al., 2013).
d. Mesure de l’acidité titrable (Martinez et al., 2012)
10 ml de chaque échantillon ont été mises dans un bécher de 250 mL, ensuite 50 mL d’eau distillée sont ajoutées. Trois gouttes de phénolphtaléine (1%) sont ajoutées tout en agitant. La titration est effectuée par la solution d’hydroxyde de sodium (NaOH) 0,1 N jusqu’à l’obtention d’une couleur rose persistante pendant10 s.L’opération est répétée trois fois.
L’acidité est déterminée par la formule suivante :
Avec :
– V : Volume d’échantillon pris pour le titrage (mL) ;
– V´ : Volume de la solution d’hydroxyde de sodium à 0,1 N utilisé (mL) ;
– 0,0067 : Facteur de conversion de l’acidité titrable en équivalent d’acide malique.
e. Mesure du degré Brix
Le degré Brix exprime le pourcentage de la concentration des solides solubles (TSS) contenus dans un échantillon. Ces solides solubles représentent le total de tous les solides dissous dans l’eau incluant : les sucres, alcools, les sels, protéines, acides,… etc.
Quelques gouttes de l’échantillon sont étalées sur le prisme du refractomètre, puis le taux de résidu sec soluble est lu sur l’échelle de cet appareil à l’intersection des zones claires et sombres.
Après chaque analyse, le plateau du prisme doit être nettoyé avec l’eau distillée et essuyé avec un chiffon doux. L’opération est répétée trois fois pour chaque échantillon (Zapata et al., 2013).
f. Mesure de la conductivité électrique
La conductivité électrique du gel et de la purée de feuilles est déterminée selon la méthode de Volkov et ses collaborateurs (2011). L’électrode de conductimètre est plongée dans un bécher contenant 30 mL d’échantillon, la lecture se fait directement sur l’afficheur du conductimètre à 23°C.
g. Mesure de la turbidité
La turbidité des échantillons est déterminée à l’aide d’un turbidimètre. La cuvette de celui-ci est remplie par l’échantillon, puis introduite dans la cellule de mesure en changeant l’échelle de mesure jusqu’à l’obtention de la valeur de turbidité exacte sur l’écran de l’appareil. L’opération est répétée trois fois.
h. Mesure de la viscosité
La viscosité des échantillons est déterminée à l’aide d’un viscosimètre. Le récipient du viscosimètre est rempli avec 250 mL d’échantillon, puis la sonde de ce dernier est introduite dans le récipient en changeant l’échelle de mesure jusqu’à l’obtention de la valeur de viscosité exacte sur l’écran de l’appareil. L’opération est répétée trois fois.
i. Test d’amidon
Des coupes minces de la feuille d’Aloe arborescens sont traitées avec la solution KI (30%).Ces dernières sont déposées sur des lames en ajoutant une goutte de la glycérine puis elle sont recouvertes de lamelles. les coupes sont examinées à l’objectif (40 x) (Femenia et al., 1999).
j. Test du changement de potentiel de la couleur du gel (Test à NaOH)
Ce test consiste à prévoir l’état de détérioration du gel par analyse visuelle après ajout d’une solution d’hydroxyde de sodium. Dans un tube à essai, 100 μL de la solution d’hydroxyde de sodium (1M) sont ajoutés à 2 mLdu gel. L’ensemble est chauffé pendant une minute au bain marée à 90ºC. Par la suite le mélange est réchauffé à la même température pendant 5 min. Le suivi de changement de la couleur est fait après chaque minute jusqu’à atteindre les cinq minutes en prenant des photos de celui-ci (O´Brien et al., 2005).
k. Dosage de la vitamine C (AOAC method no. 967.21, 2000)
Le dosage de la vitamine C est réalisé par le 2,6 dichlorophénol-indophénol (DCPIP).
Dans un erlenmeyer, un volume V´ égale à 5 mL d’échantillon mesuré avec une pipette graduée est introduit, puis 5 mL de la solution d’acide métaphosphorique-acide acétique (v/v) (HPO4-CH3COOH) et 10 mL d’eau distillée sont ajoutés. Un autre erlenmeyer témoin est réalisé avec la solution étalon d’acide ascorbique (250 mg/L).
La vitamine C est titrée avec une solution de DCIPP (8,61×10-3 mol/L),jusqu’à l’apparition d’une couleur rose persistante pendant 30 s. L’opération est répétée trois fois.
La teneur en vitamine C est déterminée par la formule suivante :
Avec :
M : masse molaire de la vitamine C (176 g/mol) ;
V : volume de DCPIP versé (mL) ;
V0 : volume de l’échantillon (mL).
l. Dosage des protéines par la méthode de Kjeldahl (A.O.A.C. no. 960.52. 2000)
On introduit dans un matras de minéralisation 1 g d’échantillon et une pincée de catalyseur (sulfate de cuivre et de potassium), puis on ajoute 15 mL d’acide sulfurique pur et on applique un chauffage progressif ; d’abord une attaque à froid pendant 15 mn jusqu’à l’apparition de vapeur blanche d’anhydride sulfurique, puis le chauffage est rendu plus énergique, attaque à chaud pendant 4 à 5 heures. Quand la solution devient limpide, elle est refroidie et complétée à 100 mL avec de l’eau distillée. La distillation est réalisée dans un distillateur semi-automatique (VELP) en ajoutant 20 mL de lessive de soude à 35 % dans le matras et 25 % d’acide borique dans une fiole de 250 mL. L’ammoniac est récupéré dans une solution d’acide borique contenant l’indicateur coloré (le réactif de TACHIRO) (mélange de bleu de méthylène et rouge de méthyle). L’excès d’ammoniac est alors dosé par l’acide sulfurique 0,05 N dans un titreur
automatique.
La teneur en azote total est déterminée par la formule suivante
Avec :
– C0 : Normalité de l’acide sulfurique (0.05) ;
– V : Volume de l’acide sulfurique versé (mL) ;
– P : Poids de la prise d’essai (g).
La teneur en protéines est calculée en multipliant le taux d’azote total N (%) par le coefficient 6,25.
m. Dosage des lipides par la méthode de Soxhlet
La teneur en lipides est déterminée selon la méthode de Femenia et ses collaborateurs (1999).
Les matras ou ballons de 500 mL ont été séchés dans une étuve à 100°C pendant 1 heure. Après refroidissement dans un dessiccateur, le poids vide a été déterminé avec une précision de 0,001g. Chaque cartouche en papier filtre reçoit 25 g d’échantillon, puis placée dans l’appareil Soxhlet. On verse 200 mL d’éther de pétrole dans le ballon et 50 mL dans l’extracteur.
Les ballons sont chauffés pendant 4 heures. Après l’élimination du solvant par distillation, le ballon est séché à une température de 70-80 °C, puis pesé après refroidissement dans un dessiccateur. L’opération de séchage est répétée jusqu’à l’obtention d’un poids constant.
La teneur en matière grasse est déterminée selon la formule suivante :
Avec :
– P1 : poids du ballon vide (g);
– P2 : poids du ballon avec l’huile extraite (g);
– P3 : poids de la prise d’essai (g).
n. Dosage des sucres totaux
Le contenu en polysaccharides est estimé selon la méthode décrite par Miranda et ses collaborateurs (2010).
5 g d’échantillon sont mélangés avec 20 mL d’éthanol 95%, après une agitation vigoureuse, le mélange est laissé macérer toute la nuit à 4°C. Ensuite le mélange est centrifugé à 5200 rpm /10 min, le surnageant est éliminé et le précipité est récupéré dans l’eau distillé et laissé toute la nuit à 4 ºC, puis précipité encore par addition 20 mL d’éthanol (95%).
Le précipité obtenu est reconstitué dans l’eau distillée et traité avec 10mL du réactif Sevag (1-butanol: chloroforme 1:4, v/v) suivi d’une agitation vigoureuse pendant 10 min à température ambiante .Une troisième centrifugation à 5200 rpm / 10 min permet de retirer le surnageant et le culot sera reconstitué dans l’éthanol 95%. Ce solvant est évaporé dans l’étuve à 45 ºC. Les particules qui restent sont pesées afin d’estimer la quantité des sucres.
o. Dosage des éléments minéraux par Spectroscopie d’Absorption Atomique (SAA)
La teneur en éléments minéraux des échantillons étudiés a été déterminée selon la méthode décrite par Boss et Freeden (1989).
Dans un tube contenant 1 mL d’acide chlorhydrique, on dissout 1 g des cendres obtenues par incinération et on ajoute avec précaution 10 mL d’eau distillée; la solution obtenue est chauffée pendant quelques minutes au bain-marie bouillant (100ºC) jusqu’à la dissolution complète des cendres. Enfin dans une fiole jaugée de 100 mL, on verse la solution, puis on complète à 100 mL avec de l’eau distillée.
A partir de cette solution le dosage des éléments minéraux suivant : le plomb, le chrome, le zinc, le fer, le cuivre, le manganèse, le cadmium en se référant à des courbes d’étalonnages (Annexe 02).
1.2.5. Analyse phyto-chimique du gel et feuilles
– Extraction des composés phénoliques totaux
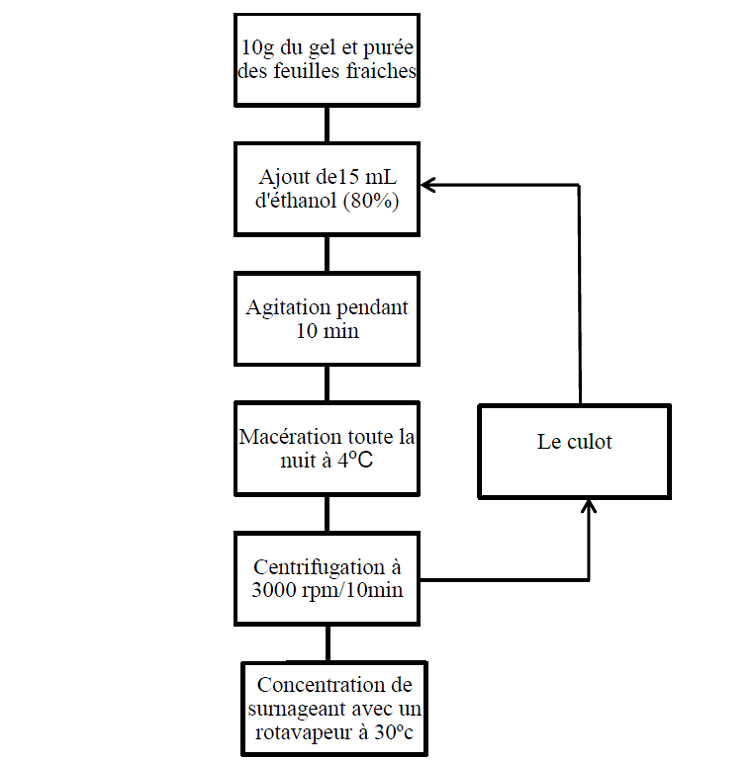
L’extraction des polyphénols a été réalisée selon la technique décrite par Bozzi et ses collaborateurs (2007).
10 g d’échantillon sont mélangés avec 15 mL d’éthanol (80%), puis agités pendant 10 min et laissés macérer toute la nuit à 4ºC, et subis une centrifugation à 3000 rpm /10 min, le surnageant obtenu est concentré à l’aide d’un rotavapeur à 30ºC (figure 11). Cette étape est répétée deux fois. L’extrait obtenu est reconstitué dans l’éthanol (80%) (figure 4).
Figure 04 : Etapes d’extraction des composés phénoliques du gel et feuilles d’Aloe arborescens
a. Dosage des composés phénoliques totaux
Le dosage des composés phénoliques totaux est déterminé selon la méthode décrite par Chuah et ses collaborateurs (2008). C’est une méthode colorimétrique, utilisant le Follin-ciocalteu comme réactif et l’acide gallique comme standard d’étalonnage.
Un volume de 0,5 mL d’extrait est ajouté à 0,5 mL du réactif Folin-ciocalteu, après 3min, 2mL de carbonates de sodium (200 mg/mL) sont ajoutés. L’ensemble est mélangé, puis les tubes sont maintenus à température ambiante et à l’obscurité pendant 15 min, ensuite 10 mL d’eau distillée sont ajoutées.
La lecture est faite à 760 nm, la concentration en composés phénoliques totaux est déterminée en se référant à la courbe d’étalonnage obtenue en utilisant l’acide gallique comme standard (Annexe 03). Les concentrations sont exprimées en mg équivalent d’acide gallique par 100g du poids frais (mg Eq AG/100g du PF).
b. Dosage des flavonoïdes
L’estimation de la teneur en flavonoïdes totaux contenus dans les extraits de gel et de la feuille est réalisée par la méthode de Loots et ses collaborateurs (2007).
La méthode de dosage des flavonoïdes repose sur la capacité de ces composés à former des complexes chromogènes avec le chlorure d’aluminium (AlCl3).
0,5 mL d’extrait sont mélangés avec 2 mL d’eau distillée et 0,15 mL de solution de NaNO2 à 15% (nitrite de sodium). Après 6 minutes, 0,15 mL d’AlCl3 à 10% sont ajoutés et laissés pendant 6 minutes, puis 2 mL de NaOH (soude) à 4% sont ajoutés. Le volume est ajusté à 5 mL avec l’eau distillée.
L’absorbance est mesurée après 15 minutes à 510 nm, La concentration des flavonoïdes est calculée en se référant à une courbe d’étalonnage obtenu en utilisant la quercétine comme standard (Annexe 03).Les concentrations sont exprimées en mg équivalent de quercétine par 100g du poids frais (mg Eq Q / 100g du PF).
c. Dosage des tanins totaux
L’estimation de la teneur en tanins totaux contenus dans les extraits est réalisée par la méthode de Hagerman et Butler (1989).
Les tanins sont connus par leur propriété principale, qui est la précipitation des protéines en fonction des facteurs liés au milieu réactionnel (pH, température et temps). L’utilisation de la BSA dans le dosage des tannins en milieu acide a pour but de séparer ces derniers des autres polyphénols présents dans l’extrait. Le chlorure ferrique (FeCl3) réagit avec les tannins (en milieu alcalin : SDS/TEA pour former des chélates de couleur violette. la préparation des solutions utilisées est plus détaillée dans l’annexe (04).
1mL d’extrait et 2 mL de la solution de BSA (1mg/mL) préparés dans le tampon acétate 0,4M, pH= 6) ont été mélangés. Après 24 heures d’incubation à 4°C, le mélange est centrifugé à 3000 rpm pendant 20 min. Le précipité est dissout dans 4 mL de la solution tampon : SDS/TEA et mis à l’obscurité pendant 15mn ,1 mL de la solution de chlorure ferrique (0,1N) est ajouté, après une incubation de 15 min, la lecture de l’absorbance est effectuée à 510 nm.
La concentration en tannins est déterminée en se référant à la courbe d’étalonnage préparée avec l’acide tannique (Annexe 03). Les concentrations sont exprimées en mg équivalent de l’acide tannique par 100g du PF (mg Eq AT/100gdu PF).
d. Dosage des anthocyanes
L’estimation de la teneur en anthocyanines est réalisée par la méthode de Çam et ses collaborateurs (2009).
Le dosage des anthocyanines est effectué selon la méthode du pH différentiel. Cette méthode utilise la propriété des anthocyanes à être sous une forme colorée et sous une forme incolore en fonction du pH du milieu. La fonction phénolique n’étant pas affectée par cette variation du pH, donc les autres composés phénoliques n’interfèrent pas, et par conséquent, la variation de la couleur est proportionnelle à la teneur en anthocyanines.
Cette méthode utilise deux systèmes tampon : Le chlorure de potassium à 0,025 M (pH1 = 1,0) et l’acétate de sodium à 0,4 M (pH2 = 4,5). 0,4 mL d’extrait est mélangé avec 3,6 mL de chaque solution tampon. Les absorbances sont mesurées à 510 et à 700 nm.
L’absorbance qui correspond aux anthocyanines est calculées comme suit :
A = (A510 – A700) pH 1 – (A510 – A700) pH2
La concentration en anthocyanines, exprimée en mg équivalent de cyanidine-3- glucoside par 100 g du PF, est calculée selon l’équation suivante :
[Anthocyanines] = A x MM x 100 / AM
A : absorbance;
MM : masse moléculaire de la cyanidine-3-glucoside (449,2 g/mol);
AM : coefficient d’absorbance molaire (26900 mol.cm. L).
e. Dosage des caroténoïdes
L’estimation de la teneur en caroténoïdes totaux contenus dans les extraits est réalisée selon la méthode de Yolanda et ses collaborateurs (2007).
2 g d’échantillon sont homogénéisés avec 20 mL du mélange de solvants suivant : (hexane/acétone/éthanol, 2:1:1). Après agitation pendant 30min, la phase supérieure est récupérée et protégée de la lumière par du papier aluminium, 10 mL d’hexane sont ajoutés et une deuxième extraction est réalisée. Le mélange des deux extractions est centrifugé pendant 5 min à 6500 rpm.
La teneur en caroténoïdes est déterminée par la mesure de l’absorbance de l’extrait hexanique à 420 nm. Les concentrations des caroténoïdes sont estimées en se référant à la courbe d’étalonnage obtenue en utilisant la β- carotène comme standard d’étalonnage (Annexe 03). Les concentrations sont exprimées en mg équivalent de la β-carotène par 100 g du PF (mg Eq β-carotène /100 g du PF).
t. Analyse qualitative de l’aloïne par HPLC
La teneur en aloïne des échantillons étudiés a été déterminée selon la méthode décrite par Himesh et ses collaborateurs (2011).
Dans un tube contenant déjà 1 mL d’eau distillée, une quantité de 1g d’échantillon est diluée, puis mélangée bien pour obtenir une solution homogène, la solution obtenue est filtrée en utilisant un filtre de 0,45 μm à l’aide d’une pompe sous vide, afin d’obtenir un liquide clair, ce dernier est concentré jusqu’à environ 5% à l’aide d’un rotavapeur à 30ºC.
Cette analyse est faite à l’aide d’un appareil d’HPLC de modèle LC-20AT, mené d’un détecteur UV-VIS, modèle SHIMADZU-SPD-20AV-Prominense, avec un dégazeur DGU-20A3 et une colonne (C-18, gel de Silice).Les conditions utilisées sont :
– Phase mobile : méthanol pur (A), acide acétique (B) 0,34%, (40% A- 60%B) ;
– Débit : 1,0 mL/min ;
– Température : 25°C ;
– Volume d’injection : 25μL ;
– Détection UV : 297,5 nm.
I.2.6.Analyse microbiologique du gel et feuilles
a. Préparation de la solution mère et des dilutions décimales
25 mL d’échantillon obtenus aseptiquement sont homogénéisés avec 225 mL d’eau peptonée (0.1%) ,1 mL de la solution mère est transférée dans un tube contenant 9 mL d’eau peptonée (0.1%), on obtiendra ainsi la dilution 10-2, de la même manière on prépare les dilutions jusqu’à 10-6 (Vega et al., 2012).
b. Dénombrement de la flore totale aérobie mésophile (FTAM) et psychrophile
1 mL de la dilution 10-6 est étalé en surface de la gélose PCA préalablement coulé et solidifié.
L’incubation est effectuée à 30 °C pendant 72 heures (pour les aérobie mésophiles) et à 7 °C pendant 10 jours (pour les psychrophiles).Après incubation, on dénombre les colonies lenticulaires pour les boites qui contiennent entre 30 et 300 colonies, on utilise deux boites Pétri pour chaque dilution (Reyes et al., 2012).
c. Dénombrement des coliformes totaux (CT) et thermo-tolérants (CTT)
L’ensemencement se fait en masse, en déposant au fond des boites de Pétri 1 mL de la dilution 10-3 (CT) et 10-2 (CTT), Puis la gélose VRBL fondue et refroidie à 45°C est coulée et homogénéisée avec l’échantillon. L’incubation se faite à 37 °C pour les CT et à 44°C pour les CTT pendant 24 à 48 heures, en utilisant deux boites pour chaque dilution (Shao et al., 2013).
d. Dénombrement des levures et moisissures
1 mL de la dilution 10-1 est étalé sur la surface de la gélose Sabouraud préalablement coulé et solidifié. L’incubation est effectuée à 25ºC pendant 3 à 5 jours. On utilise deux boites pour chaque dilution (Reyes et al., 2012).
e. Recherche de Staphylococcus aureus
On ensemence le milieu Giolitti-Cantoni (additionné de 1 mL de tellurite de potassium) par 1mL d’échantillon, l’incubation se fait à 37°C pendant 24 heures.
Après incubation, s’il y a noircissement du milieu, on confirme la présence des staphylocoques par isolement sur la gélose Baird Parker par 1 mL du milieu positif en surface. L’incubation est faite à 37 °C/ 24 à 48 heures (Shao et al., 2013).
f. Recherche des salmonelles (Shao et al., 2013)
– Pré- enrichissement
25mL d’échantillon sont mis dans 225 mL d’eau peptonée, puis l’incubation est faite à 37°C/24h.
– Enrichissement
On ensemence un tube du milieu SFB avec 10 mL prélevés de la solution du pré enrichissement. L’incubation se fait à 37°C/24h.
– Isolement
On ensemence 1mL de la solution d’enrichissement sur milieu Hecktoen. L’incubation est faite à 37°C/24 à 48h.
I.2.7.Etude de quelques activités biologiques
a. Activité anti-radicalaire (Turkmen et ses collaborateurs,2005).
L’activité anti-radicalaire est déterminée en utilisant le DPPH.
2 mL de DPPH (0,15 mmol / L) sont mélangés avec 1 mL de chaque extrait. L’ensemble est mélangé à l’aide d’un vortex pendant 30 s, puis porté à l’obscurité à température du laboratoire pendant 20 min. Après cette durée, l’absorbance est mesurée à 517 nm.
L’activité anti-radicalaire est exprimée en pourcentage d’inhibition du DPPH et déterminé par l’équation suivante :
b. Activité antibactérienne
La méthode utilisée est celle décrite par He (2011).Des disques de papier filtre stériles de 3mm de diamètre, sont imprégnés de 20 μL d’extraits, puis déposés à la surface de milieu Muller-Hinton, déjà coulé dans les boites de Pétri et préalablement ensemencée en surface par inondation à l’aide d’une suspension bactérienne d’Escherichia coli et autre de staphylococcus aureus (Annexe 05).La suspension est préparée, à partir d’une culture fraiche de 18-24h, en mélangeant deux colonies dans 1mL d’eau physiologique stérile.
Après incubation à l’étuve à 37°C pendant 18 à 24h. La lecture des résultats est faite par la mesure des diamètres des zones d’inhibition en mm.
c. Activité antifongique
L’activité antifongique est déterminée par la méthode décrite par de Saks et Barkai (2011). Cette activité est basée sur la suppression de la croissance mycélienne du Trichoderma viride. Un ensemencement par 1mL d’une suspension contenant le champignon est réalisé dans deux boites de Pétri contenant la gélose PDA préalablement coulée et solidifiée, puis 20μL des extraits sont mis dans les puits préalablement formés, sans oublier les puits de témoins. Les cultures sont incubées à 24 ± 2 ºC/ 7jours. Après cette durée, le diamètre des zones d’inhibition est mesuré avec une règle en mm.
I.2.8.Essai de fabrication de la boisson médicinale et l’évaluation de sa qualité
La préparation de la boisson médicinale «Arbojus» à base de gel d’Aloe arborescens et du miel (AL-Shifa) a été réalisée au niveau de laboratoire de microbiologie à l’université de Jijel.
I.2.8.1.Ingrédients utilisés
Cette boisson contient les ingrédients suivants :
– Gel d’Aloe Arborescens ;
– Miel d’abeille – «AL-Shifa» ;
– Eau minérale (Texanna) ;
– Jus de citron ;
– Acide citrique.
I.2.8.2. Contrôle de qualité des ingrédients
a. Analyses physico-chimiques
Les paramètres physico-chimiques évalués sont: la teneur en eau, la teneur en cendre, le pH, l’acidité titrable, le degré Brix, la conductivité électrique, et le dosage de la vitamine C. Les techniques utilisées sont déjà décrites en I.2.4. Just pour le miel qui nécessite une préparation d’une solution de miel à 10% (pour la mesure de pH et l’acidité) et 20% (pour la mesure de la conductivité électrique).
b. Analyses microbiologiques
La FTAM, les CT et les CTT, les levures et moisissures, les salmonelles, staphylococcus aureus ont été dénombrés et/ou recherchées selon les techniques déjà décrites en I.2.6.
I.2.8.3.Test de toxicité du gel
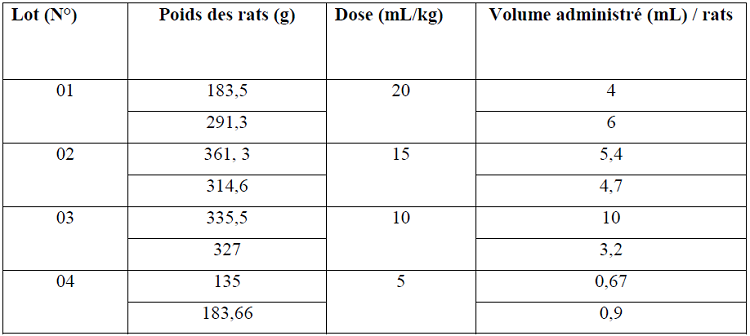
Le test de la toxicité est réalisée sur 8 rats de type Wistar albinos pesant entre 135 et 361,3 g, provenant de l’animalerie de l’université de Constantine. Ils ont été gardés et maintenus dans les conditions de température et lumière ambiante, par gavage selon la méthode décrite par Ghosh et ses collaborateurs (2011).
Les rats ont été aléatoirement divisés en quatre groupes, chaque groupe est composé de deux rats. Ces derniers reçoivent des doses déférentes (tableau 08) du gel par gavage comme voie d’administration. Le tableau ci-dessous résume les doses administrées.
Tableau 08 : Doses et volumes du gel administré aux rats
Après l’opération de gavage, les rats ont été suivis après 2h, 3h, et 4h par un contrôle visuel des paramètres suivants :
– Comportement des rats (présence d’un stress ou non) ;
– Elimination des déchets ;
– Etat de poils des rats (indice de douleur) ;
– Respiration.
I.2.8.4. Diagramme de fabrication
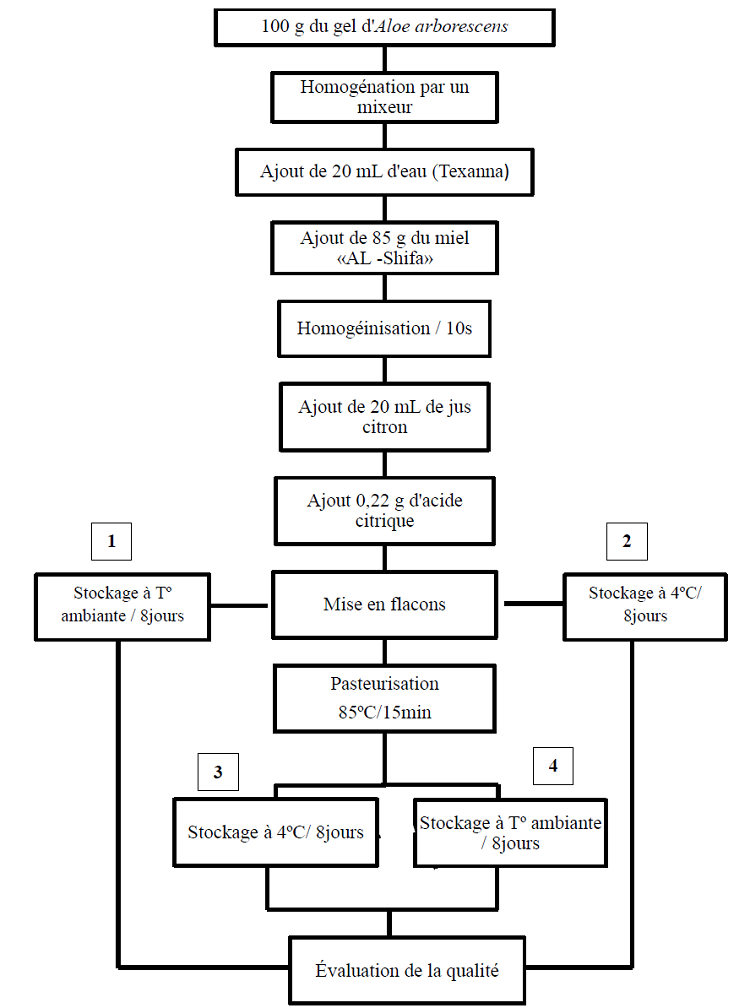
Le diagramme de fabrication est illustré par la figure 12, 100 g du gel sont homogénéisés à l’aide d’un mixeur (Moulinex), ensuite 20 mL d’eau (Texanna), 85 g du miel (AL-Shifa) et 20 mL de jus citron sont additionnés, après homogénéisation avec 0.29 g d’acide citrique, ce mélange est conditionné dans un emballage en verre fumé, puis pasteurisé à 85ºC/15 min et refroidie immédiatement à 4ºC.
Figure 05 : Diagramme de fabrication de la boisson médicinale «Arbojus» à base du gel d’Aloe arborescens et du miel «AL -Shifa»
d. Emballage et Etiquetage
L’emballage adopté pour notre boisson doit être en verre fumé, afin d’éviter l’oxydation de ses composés bioactifs, et aussi de préserver sa qualité nutritionnelle.
L’étiquette doit porter les information suivantes: la dénomination de la boisson (Arbojus), liste et quantités des ingridients , le poids net, lieu et date de fabrication , température de conservation et mode d’utilisation.
I.2.8.5.Contrôle de qualité du produit fini
Au cours de la fabrication de la boisson, le gel reçoit des constituants de différentes nature, sucré (miel), acide (jus citron et acide citrique), et l’eau ce qui lui donne une composition assez déférente à celle du gel.
– Augmentation du pH et diminution de l’acidité ;
– Changement de la teneur en eau et en cendres ;
– Elévation du taux d’acide ascorbique ;
– Augmentation de la teneur en polyphénols totaux, flavonoïdes, tanins, anthocyanes ;
– Augmentation de la teneur en TSS (sucres).
a. Analyses physico-chimiques
Les mêmes protocoles utilisés pour la caractérisation physicochimique du gel et des feuilles sont appliqués pour la détermination de la teneur en eau, en cendres, pH, acidité titrable, le degré Brix, taux de vit C, viscosité, conductivité électrique, Turbidité, teneur en sucres, teneur en lipides. Les techniques utilisées sont déjà décrites en I.2.4.
b. Analyses microbiologique
Les mêmes protocoles utilisés pour l’analyse microbiologique du gel et des feuilles, sont appliqués pour évaluer la qualité hygiénique de la boisson médicinale, juste pour la recherche de la flore osmophile, la méthode est décrite ci-dessous.( Guiraud,2003).
Recherche de la flore osmophile
La gélose à l’extrait de malt additionné de 20 % de glucose est ensemencée en masse par 1 ml de la solution mère (boisson fabriquée).L’incubation a été réalisé à 25º C pendant 3 à 10 jours.
I.2.8.6. Analyse sensorielle
L’évaluation sensorielle vise à mesurer le degré d’acceptation de notre boisson par un jury de dégustation composé de 20 personnes, considérées comme dégustateurs amateurs recrutés pour une démarche hédonique (Annexe 06).Cette analyse a été réalisée dans un endroit calme et propre.
I.2.8.7. Tests de stabilité (Guiraud, 2003)
Afin d’évaluer l’efficacité de l’étape de pasteurisation, les conditions de fabrication et de stockage, des tests de stabilité (analyses physicochimiques et microbiologiques) ont été réalisés sur la boisson pasteurisée, non pasteurisée, conservée à température ambiante et à 4ºC durant 8 jours de stockage. En les comparant avec la boisson fraiche avant stockage et sans traitement.